Hukum Kekekalan Massa (Pembahasan Lengkap)
Seiring berjalannya waktu kita sudah memasuki era informasi, dimana kita bisa dengan mudah mendapatkan semua informasi yang kita butuhkan melalui internet. Tak bisa dipungkiri bahwa hal tersebut pula yang "mengilhami" kami untuk membuat sebuah wadah guna menampung berbagai informasi yang kami anggap penting terutama untuk para siswa yang saat ini menjalani proses belajar mengajar secara online serta untuk umum. Maka terbentuklah situs Pembahasan Lengkap.
Penjelasan Lengkap Hukum Kekekalan Massa
Selamat datang di Dosen.co.id, web digital berbagi ilmu pengetahuan. Kali ini PakDosen akan membahas tentang Hukum Kekekalan Massa? Mungkin anda pernah mendengar kata Hukum Kekekalan Massa? Disini PakDosen membahas secara rinci tentang hukum, rumus dan contoh soalnya secara lengkap. Simak Penjelasan berikut secara seksama, jangan sampai ketinggalan.
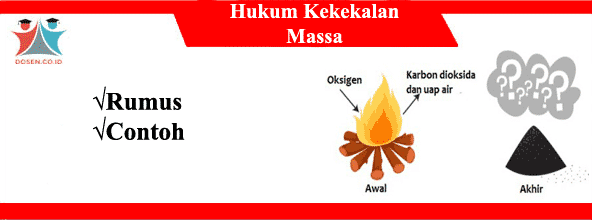
Hukum Kekekalan Massa
Hukum kekekalan massa merupakan sebuah hukum yang menyatakan massa dari suatu sistem tertutup akan konstan meskipun terjadi berbagai macam proses di dalam sistem tersebut apabila(dalam sistem tertutup Massa zat sebelum dan sesudah reaksi adalah sama (tetap/konstan).
Pada awal abad ke-18, para kimiawan dalam usahanya mempelajari kalor dan pembakaran menemukan hal yang sangat aneh. Contohnya: jika kayu dibakar, maka akan menghasilkan residu abu (padatan) yang jauh lebih ringan daripada kayu semula. Akan tetapi, jika logam dibakar di udara bebas, maka akan menghasilkan oksida yang lebih berat dibandingkan logam semula. Mengapa demikian?
Pada kimiawan mengembangkan metode eksperimen secara cermat dengan mengguanakan neraca kimia dalam mengukur volume atau masa gas, cair, dan padat yang terjadi pada reaksi kimia. Oleh karena itu, massa reaktan dan hasil reaksi dapat diukur dengan cermat. Hasil eksperimen tersebut menyajikan fakta kepada pengamat dan menuntun mereka ke perumusan hukum fundametal (dasar) yang menguraikan sifat kimia. Hukum dasar yang diperoleh dikenal dengan hukum kekekalan massa, yaitu sebagai berikut:
Massa tidak dapat diciptakan maupun dimusnahkan dalam perubahan materi apa pun.
Fakta hukum dasar kekekalan massa sudah dibuktikan pada tahun 1756 oleh ilmuan Rusia, M.V. Lomonosov. Mungkin karena masalah bahasa karyanya tidak dikenal di Eropa barat secara meluas. Secara terpisah pada tahun 1783, seorang kimiawan besar Perancis, Antoine Lavoisier melakukan hal yang sama dengan menggunakan neraca kimia untuk menunjukan bahwa jumlah dari massa hasil reaksi kimia sama dengan jumlah massa reaktanya.
Lavoisier melakukan eksperimen dengan memanaskan merkuri dalam labu tertutup yang berisi udara. Setelah beberapa hari, terbentuk zat berwarna merah yaitu merkuri (II) oksida. Gas dalam tabung massanya berkurang dan tidak dapat lagi menyangga pembakaran [lilin dalam tabung tidak menyala lagi] dan hewan akan mati jika dimasukan kedalamnya. Hal itu menunjukan bahwa gas oksigen dalam tabung sudah habis. Sekarang diketahui bahwa gas yang tersisa adalah nitrogen, sedangkan oksigen dari udara dalam tabung telah habis bereksi dengan merkuri. Selanjutnya, lavoisier mengambil oksida merkuri tersebut dan memanasknya sehingga terurai kembali. Kemudian Dia menimbang merkuri dan gas yang dihasilkanya. Ternyata, massa gabungannya sama dengan massa merkuri (II) oksida yang digunakan semula. Akhirnya, setelah beberapa kali dilakukan eksperimen dan hasilnya sama, lavoisier menyatakan hukum kekekalan massa yaitu, sebagai berikut.
Dalam setiap reaksi kimia, massa zat sebelum dan sesudah reaksi selalu sama.
Bunyi hukum kekekalan masa:
Hukum Kekekalan Massa menyatakan massa zat-zat sebelum reaksi sama dengan massa zat-zat sesudah reaksi.
Rumus Hukum Kekekalan Massa
Lavoiser adalah orang pertama yang mengamati bahwa reaksi kimia analog dengan persamaan aljabar. Oleh karena itu sekarang kita dapat menuliskan reaksi yang kedua di atas sebagai berikut.
2HgO – 2Hg + O2
Sebagai gambaran dari hukum kekekalan massa dari lavoisier itu, dapat kita lihat pada contoh-contoh berikut ini.
- Pembakaran bensin secara sempurna.
bensin + oksigen – karbon dioksida + uap air
massa pereaksi = massa hasil reaksi
- Gas hidrogen bereaksi dengan gas oksigen membentuk air.
2H2(g) + O2(g) – 2H2O(l)
1 gram 8 gram 9 gram
2 gram 16 gram 18 gram
3gram 24 gram 27 gram
- Besi bereaksi dengan belereng.
Fe(s) + S(s) – FeS(s)
56 gram 32 gram 88 gram
28 gram16 gram 44 gram
112 gram 64 gram 176 gram
Contoh Soal Hukum Kekekalan Massa
Besi direaksikan dengan belerang, data-data sebagai berikut.
Fe + S – FeS
56 gram 32 gram 88 garam
28 gram 16 gram 44 gram
jika besi belerang yang dapat direaksikan masing-masing 64 gram, maka hitunglah massa besi dan belerang yang bereaksi, massa FeS yang terbentuk, dan massa zat yang tersisa!
Pembahasan
Dari data reaksi diperoleh persamaan sebagai berikut.
Massa Fe : S : FeS = 56 : 32 : 88
jika 64 gram S habis bereaksi, maka Fe yang dibutuhkan adalah:
56/32 x 64 gram = 112 gram [tidak mungkin karena Fe yang ada hanya 64 gram].
Berarti zat yang habis bereaksi adalah Fe = 64 gram
S yang dibutuhkan adalah 32/56 x 64 gram = 36,6 gram
S sisa adalh [64-36,6] gram = 27,4 gram
FeS yang terbentuk = 88/56 x 64 gram = 100,6 gram.
massa zat sebelum reaksi = massa Fe + S yang direksikan
=[64+64] gram = 128
massa zat setelah reaksi =massa FeS + S sisa
=[100,6 + 27,4] gram = 128 gram
Demikian Penjelasan Materi Tentang Hukum Kekekalan Massa, Rumus dan Contoh Soalnya Secara Lengkap
Semoga Materinya Bermanfaat Bagi Siswa-Siswi
The post Hukum Kekekalan Massa first appeared on PAKDOSEN.CO.ID.
ARTIKEL PILIHAN PEMBACA :
Comments
Post a Comment